TEORI ATOM
Assalamualaikum Warrahmatullahi Wabarakatuh
Halo sobat kimia😄
Pada pertemuan kali ini, kita akan membahas tentang TEORI ATOM. nantinya kita akan mempelajari bagaimana para ilmuwan melihat dan memahami dunia atom. Ayo kita belajar bersama ^^
Pernahkah kalian berpikir bagaimana jika seandainya sepotong besi dipotong menjadi dua, kemudian setiap bagian yang kecil di potong menjadi dua bagian lagi dan seterusnya sampai bentuk yang terkecil. Kira-kira apa yang akan diperoleh? Pernahkah juga kalian berpikir hamparan pasir di pantai yang dari kejauhan tampak seperti hamparan permadani, tetapi ketika didekati dan dipegang, ternyata hanya butiran-butiran kecil.
Nah sobat kimia, seperti itulah semua zat yang ada di dunia yang tersusun atas partikel-partikel paling kecil yang menyusun zat yang lebih besar. Partikel-partikel terkecil yang menyusun setiap zat ini oleh para ilmuwan dikenal dengan sebutan ATOM.
Konsep atom pertama kali dikemukakan oleh Democritus dan Leucippus pada abad ke-5. Mereka awalnya berandai-andai apa yang akan terjadi jika suatu benda dimana contohnya yaitu kayu dipotong secara terus menerus menjadi bagian yang kecil, apakah akan selalu ada potongan kayu yang lebih kecil?.
Nah, mereka berdua ini kemudian menyimpulkan bahwa jika suatu benda dipotong secara terus menerus, maka akan diperoleh ukuran yang tidak dapat dibagi lagi. Bagian terkecil ini disebut sebagai ATOM.
Atom berasal dari "atomos" yang terdiri dari kata a dan tomos. Dalam bahasa yunani a = tidak, sedangkan tomos = dibagi.
Dari penemuan konsep atom tersebut mengakibatkan para ilmuwan berbeda pendapat tentang atom. Perbedaan tersebut didasarkan pada eksperimen yang dilakukan sehingga model atom mengalami banyak perubahan sesuai dengan perkembangan ilmu pengetahuan.
Berikut tokoh-tokoh yang ada dalam perkembangan teori atom.
1. Teori Atom Dalton
Tokoh pertama yang mengawali perkembangan teori atom ialah John Dalton. Pada tahun 1803, ia berpendapat bahwa atom merupakan bagian terkecil dari suatu materi yang tidak dapat dibagi lagi.
Teori Atom Dalton ini memberikan gambaran model atom seperti bola pejal atau bola billiard.- Dapat menerangkan Hukum Kekekalan Massa (Hukum Lavoisier)
- Dapat menerangkan Hukum Perbandingan Tetap (Hukum Proust)
- Tidak dapat menjelaskan sifat listrik materi
- Tidak dapat menjelaskan cara atom-atom saling berikatan
- Tidak dapat menjelaskan perbedaan antara atom unsur yang satu dengan unsur yang lain
2. Teori Atom Thomson
Tokoh kedua ialah Joseph John Thomson. Pada tahun 1897, ia berpendapat bahwa atom merupakan bola pejal yang memiliki muatan positif yang menyebar merata dan dinetralkan oleh muatan negatif (elektron).
Percobaan J.J Thomson menggunakan tabung sinar katoda membantu mendukung ide ini. Teori Atom Thomson ini diibaratkan dengan model atom roti kismis.
- Dapat membuktikan adanya partikel lain yang bermuatan negatif dalam atom
- Tidak dapat menjelaskan susunan muatan positif dan negatif dalam bola atom tersebut
- Tidak dapat menjelaskan inti atom
3. Teori Atom Rutherford
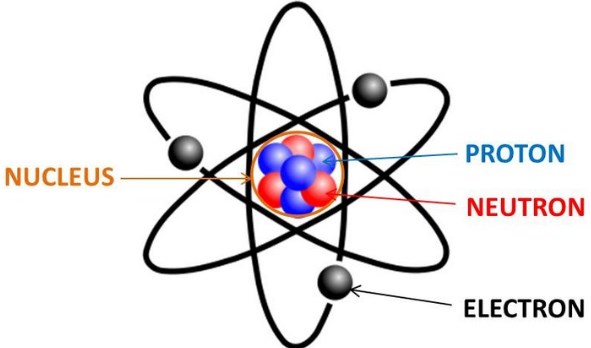
Tokoh ketiga ialah Ernest Rutherford. Pada tahun 1910, ia berpendapat bahwa muatan inti atom sama dengan massa atom dalam sma (satuan massa atom). Inti atom yang terkena partikel alfa maka akan terjadi tumbukan yang menyebabkan pembelokan atau pemantulan partikel alfa. Penyebab terjadinya hal itu adalah massa dan muatan atom terpusat pada inti (nukleus)
Eksperimen penembakan inti atom lepengan emas dengan partikel alfa. Teori Atom Rutherford ini diibaratkan dengan model tata surya.
- Dapat membuat hipotesis bahwa atom tersusun dari inti atom dan elektron yang mengelilingi inti
- Dapat menjelaskan atom bersifat netral karena muatan positif sebanding dengan muatan negatif
- Selama mengelilingi inti, gaya sentripetal pada elektron terbentuk oleh gaya tarik menarik antara elektron dengan gaya inti atom (gaya coulomb)
- Tidak dapat menjelaskan mengapa elektron tidak jatuh ke dalam inti atom
- Tidak dapat menjelaskan cara rotasi dari inti atom dan letak dari elektron
- Tidak dapat menjelaskan spektrum garis yang ada pada atom hidrogen
- Energi atom menjadi tidak stabil karena elektron yang bergerak akan memancarkan energi
4. Teori Atom Bohr
Tokoh keempat ialah Niels Bohr. Pada tahun 1922, ia berpendapat bahwa atom merupakan inti bermuatan positif yang dikelilingi elektrom bermuatan negatif yang hanya melintasi lintasan-lintasan tertentu. Pada lintasan-lintasan tersebut elektron tidak menyerap atau memancarkan radiasi atau energi.
Teori Atom Bohr ini diibaratkan seperti peredaran planet saat mengitari tata surya.
- Dapat meramalkan garis-garis dalam spektrum atom hidrogen
- Elektron mengelilingi atom pada orbit tertentu
- Selama berada pada lintasan, energi elektron tetap sehingga tidak ada energi yang diserap atau dipancarkan
- Elektron hanya bisa berpindah dari satu kulit ke kulit lainnya dengan menyerap atau memancarkan energi
- Jika atom-atom dieksitasi diletakkan pada medan magnet maka akan timbul garis-garis halus
- Tidak dapat menjelaskan spektrum atom dengan jumlah elektron yang lebih banyak
- Tidak dapat menjelaskan efek Zeeman
- kulit elektron yang mengelilingi inti berbentuk elips bukan lingkaran
- Bohr berpendapat bahwa elektron hanya sebagai partikel dan gelombang
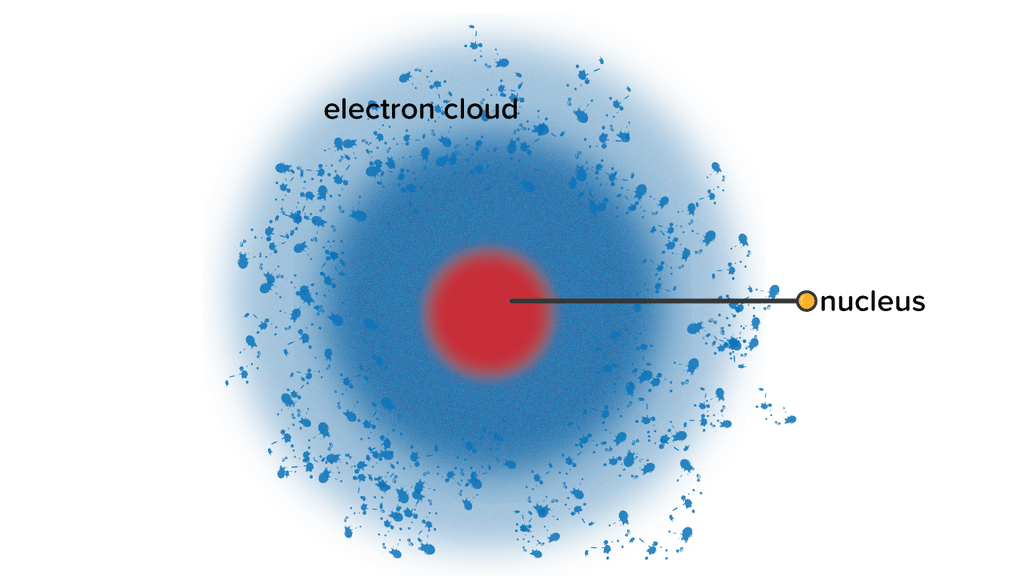
5. Teori Atom Mekanika Kuantum
Tokoh kelima ialah Werner Heisenberg dan Erwin Schrodinger. Pada tahun 1933, ia berpendapat bahwa berlaku sifat dualisme pada elektron, yaitu elektron bukan hanya sekedar sebagai partikel, tetapi juga sebagai gelombang. Dengan kata lain, elektron akan bergerak seperti gelombang dan memiliki lintasan yang juga merupakan gelombang. Pada lintasan-lintasan tersebut elektron tidak menyerap atau memancarkan radiasi atau energi.
Dari asas Heisenberg menyimpulkan bahwa terdapat suatu keterbatasan dalam menentukan posisi dan momentul elektron. Teori atom mekanika kuantum bisa dikatakan sebagai teori paling mutakhir dari beberapa teori atom yang sudah dikembangkan.
Teori Atom Mekanika Kuantum ini diibaratkan seperti awan elektron.






Komentar
Posting Komentar