KONFIGURASI ELEKTRON
Assalamualaikum Warrahmatullahi Wabarakatuh
Halo sobat kimia😄
Pada pertemuan kali ini, kita akan membahas tentang KONFIGURASI ELEKTRON. nantinya kita akan mempelajari bagaimana cara menentukan letak suatu unsur dalam tabel periodik. Ayo kita belajar bersama ^^
Pernahkah kalian memperhatikan bangunan hotel? Dari gambar di atas kita bisa melihat bahwa hotel tersebut terdiri atas beberapa lantai. Setiap lantainya terdapat banyak kamar. Untuk susunan lantai dan kamar hotel sama dengan pembahasan kita kali ini yaitu susunan elektron pada kulit atom yang dikenal dengan konfigurasi elektron.
A. Konfigurasi Elektron
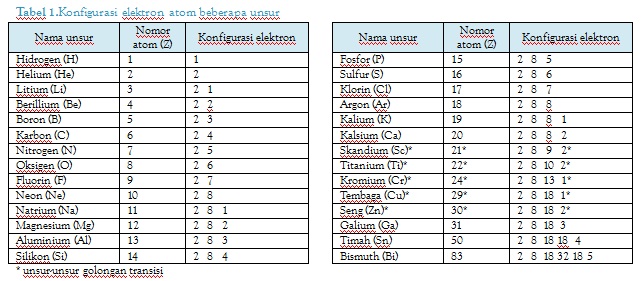
Konfigurasi elektron adalah penyusunan atau penataan elektron dalam suatu atom. Konfigurasi elektron digunakan untuk menentukan letak suatu unsur dalam tabel periodik. Jumlah elektron valensi menunjukkan golongan, sedangkan jumlah kulitnya menunjukkan periodenya. Penetapan golongan dan periode adalah dengan cara menuliskan konfigurasi elektronnya.
- penetapan golongan untuk :
1) golongan utama ditentukan dengan konfigurasi elektron pada kulit-kulit elektronnya
2) golongan transisi ditentukan dengan konfigurasi elektron menurut aufbau
Terdapat dua cara dalam penulisan konfigurasi elektron :
1. Konfigurasi Elektron berdasarkan kulit
Contoh :
2. Konfigurasi Elektron berdasarkan Model atom mekanika kuantum
Terdapat empat aturan dalam penulisan konfigurasi elektron yaitu :
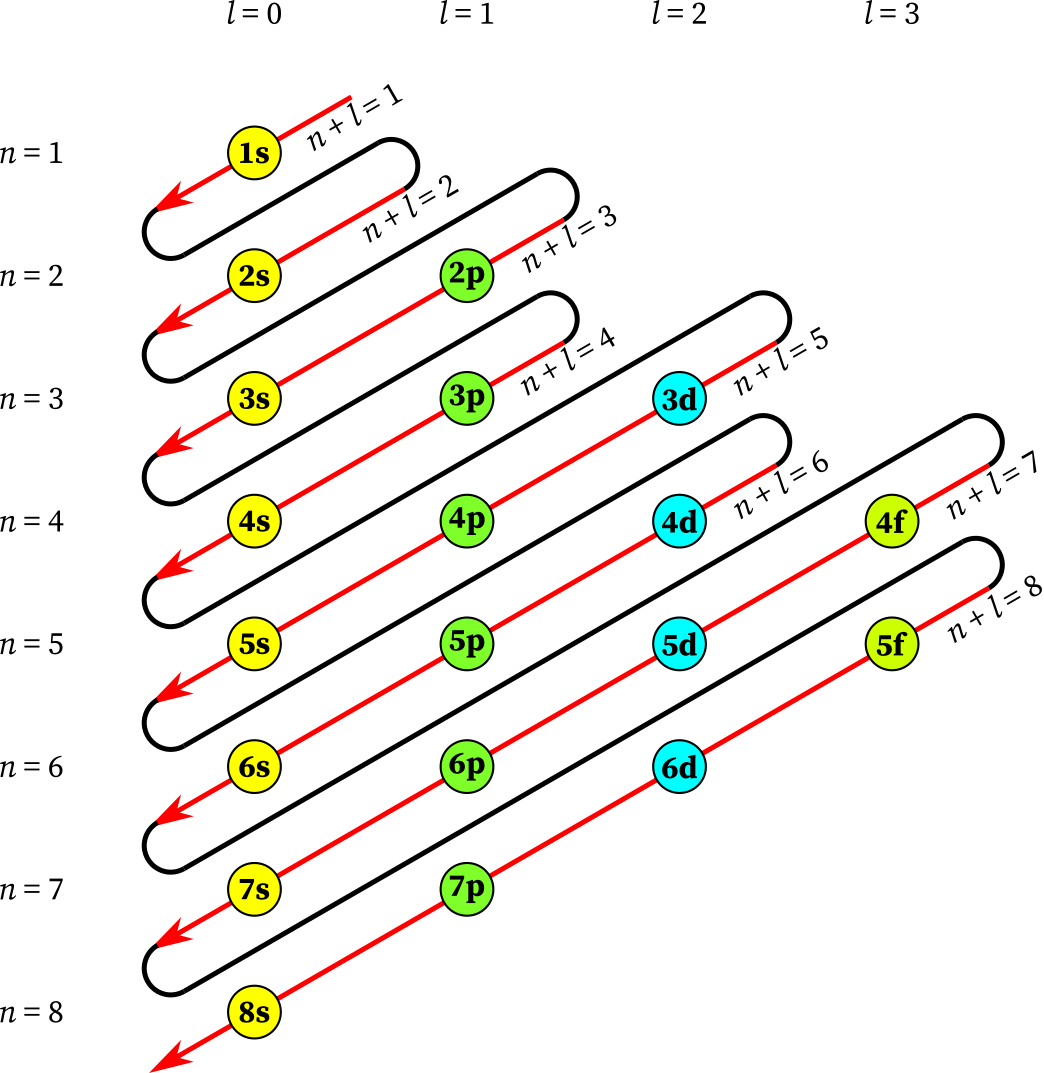
a. Aturan Aufbau
Elektron menempati pada orbital dimulai dari tingkat energi terendah ke tingkat energi yang lebih tinggi. Kalian bisa perhatikan gambar dibawah ini, dimana pengisian elektron dimulai dari 1s karena memiliki energi terendah
sebelumnya kita sudah belajar kalau setiap kulit memiliki daya tampung elektron yang berbeda-beda.Contoh :
-penentuan golongan :
1) jika pada konfigurasi elektron, elektron valensi terletak pada orbital s atau p maka unsur tersebut termasuk golongan utama atau A
ns^x np^y
golongan = (x+y) A
periode = n
2) jika terletak pada orbital d maka golongan transisi atau B
ns^x (n-1) d^y
- Jika (x+y) = 3, maka gol III B
- Jika (x+y) = 4, maka gol IV B
- Jika (x+y) = 5, maka gol V B
- Jika (x+y) = 6, maka gol VI B
- Jika (x+y) = 7, maka gol VII B
- Jika (x+y) = 8/9/10, maka gol VIII B
- Jika (x+y) = 11, maka gol I B
- Jika (x+y) = 12, maka gol II B
b. Aturan Hund
Dalam pengisian orbital yang setingkat, elektron-elektron cenderung tidak berpasangan sebelum semua orbital terisi penuh oleh elektron. Pengisian elektron dalam suatu orbital dengan tingkat energi yang sama terlebih dahulu diisi secara sendiri-sendiri, kemudian dilanjutkan secara paralel.
Contoh :
c. Azaz Larangan Pauli
Prinsip ini menerangkan bahwa dalam satu atom tidak boleh ada dua elektron yang mempunyai keempat bilangan kuantum (n, l, m, dan s) yang sama. Jadi, setiap orbital hanya dapat berisi dua elektron dengan arah spin yang berlawanan.
Contoh :
1.) konfigurasi 1s2
2.) 15 X = 1s2 2s2 2p6 3s2 3p3
d. Aturan Penuh-Setengah Penuh
Subkulit d cenderung penuh (d^10) atau setengah penuh (d^5) cenderung lebih stabil.
Contoh :
24 Cr = 1s2 2s2 2p6 3s2 3p6 4s1 3d5 (setengah penuh) 👍
bukan 1s2 2s2 2p6 3s2 3p6 4s2 3d4 (ini salah)👎







Komentar
Posting Komentar