STRUKTUR ATOM
Assalamualaikum Warrahmatullahi Wabarakatuh
Halo sobat kimia😄
Pada pertemuan kali ini, kita akan membahas tentang STRUKTUR ATOM. Di pembelajaran sebelumnya kalian telah mempelajari tentang perkembangan teori atom. Jadi materi kali ini lanjutan dari materi sebelumnya yang nanntinya kita akan mempelajari bagaimana struktur atom, lambang atom, isotop, isoton, isobar, dan isoelektron. Ayo kita belajar bersama ^^
1. Struktur Atom
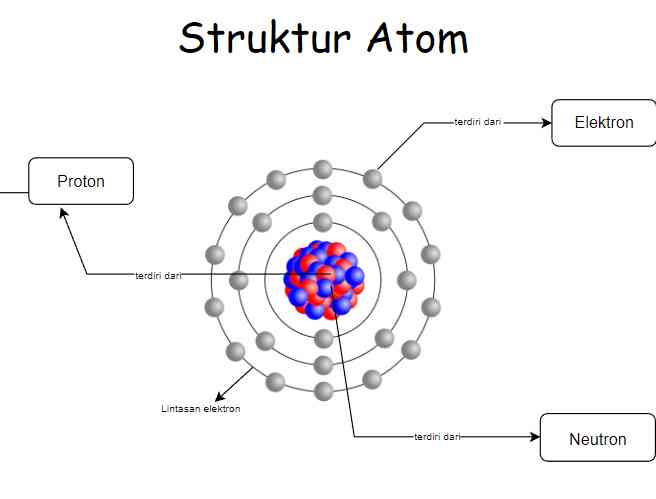
Sebelumnya kita sudah belajar bahwa atom adalah bagian terkecil yang tidak bisa dibagi lagi dari suatu benda. Atom juga terdiri dari inti atom (proton dan neutron) dan juga elektron.
Ketiga partikel dasar penyusun atom ini mempunyai perbedaan. Proton yaitu bermuatan positif (+). Sedangkan elektron yaitu bermuatan negatif (-), dan dalam sebuah atom neutron bersifat netral atau atom tidak bermuatan,
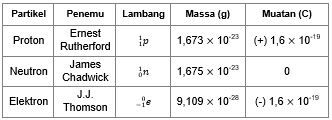
Dimana elektron mengelilingi inti atom dan menempati lintasan pada tingkat energi tertentu. Jumlah proton dalam inti sama dengan jumlah elektron yang mengelilingi inti sehingga atom bersifat netral. supaya kalian lebih jelas dalam memahaminya, di bawah ini ada tabel partikel dasar penyusun atom :
2. Lambang Atom
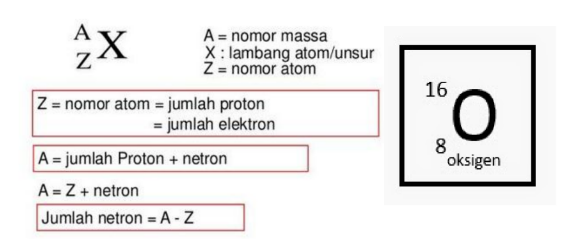
Suatu unsur dapat dinotasikan sebagai berikut
contohnya pada atom Oksigen, dimana X atau lambang atom tersebut yakni O. Kemudian A merupakan nomor massa yakni 16, dan z merupakan nomor atom yakni 8.
Contoh Lainnya :
a. Atom Netral
Atom Netral artinya atom tersebut tidak memiliki muatan.
Tentukan nomor atom, nomor massa, jumlah proton, jumlah elektron dan jumlah neutron dari unsur
Jawab :
dari lambang unsur ini diketahui bahwa :
C = lambang atom karbon
12 = nomor massa
6 = nomor atom
sedangkan untuk cara menjawabnya
- Proton (p) = nomor atom = 6
- Elektron (e) = proton = 6
- Neutron (n) = nomor massa - nomor atom
= 12 - 6
= 6
b. Atom Bermuatan
* Muatan Positif
Atom yang memiliki muatan + (kation) adalah suatu atom yang terbentuk dari atom netralnya dengan melepaskan suatu elektron. Dimana elektron (e) = nomor atom - muatan
Tentukan nomor atom, nomor massa, jumlah proton, jumlah elektron dan jumlah neutron dari unsur
Jawab :
dari lambang unsur ini diketahui bahwa :
Al = lambang atom aluminium
27 = nomor massa
13 = nomor atom
+3 = muatan
sedangkan untuk cara menjawabnya
- Proton (p) = nomor atom = 13
- Elektron (e) = nomor atom - muatan
= 13 - 3
= 10
- Neutron (n) = nomor massa - nomor atom
= 27 - 13
= 14
* Muatan negatif
Atom yang memiliki muatan - (anion) adalah suatu atom yang terbentuk dari atom netralnya dengan menyerap suatu elektron. Dimana elektron (e) = nomor atom + muatan
Tentukan nomor atom, nomor massa, jumlah proton, jumlah elektron dan jumlah neutron dari unsur
Jawab :
dari lambang unsur ini diketahui bahwa :
S = lambang atom sulfur
32 = nomor massa
16 = nomor atom
-2 = muatan
sedangkan untuk cara menjawabnya
- Proton (p) = 16
- Elektron (e) = nomor atom + muatan
= 16 + 2
= 18
- Neutron (n) = nomor massa - nomor atom
= 32 - 16
= 16
3. Isotop, Isobar, dan Isoton
a. Isotop
📌Cara praktis ➱ TOP = ATOM
contoh :
dari contoh diatas diketahui kedua atom tersebut memiliki
-nomor atom yang sama yakni 7
-nomor massa yang berbeda yakni 14 dan 15
b. Isobar
isobar = nomor massa sama, tetapi nomor atom berbeda
📌Cara praktis ➱BAR = MASSA
contoh :
dari contoh diatas diketahui kedua atom tersebut memiliki
-nomor massa yang sama yakni 14 pada atom C dan N, dan memiliki nomor massa yang sama yakni 24 pada atom Mg dan Na
-nomor atom yang berbeda yakni 6 dan 7 pada atom C dan N, dan memiliki nomor atom yang berbeda yakni 12 dan 11 pada atom Mg dan Na
c. Isoton
isoton = jumlah neutron sama, tetapi nomor atom dan nomor massa berbeda
📌Cara praktis ➱TON = NEUTRON
contoh :
dari contoh diatas diketahui kedua atom tersebut memiliki
-elektron yang sama yakni 15 pada atom P dan S, dan memiliki nomor massa dan nomor atom yang berbeda
-elektron yang sama yakni 20 pada atom Ca dan K, dan memiliki nomor massa dan nomor atom yang berbeda
d. Isoelektron
isoelektron = memiliki jumlah elektron yang sama pada kation atau anion
contoh :
dari contoh diatas diketahui kedua atom tersebut memiliki
-elektron yang sama yakni 34 pada atom Cl dan S, dan memiliki nomor massa dan nomor atom yang berbeda
Jadi itulah penjelasan terkait struktur atom. Untuk penjelasan lebih lanjut yuk simak video berikut ini







Komentar
Posting Komentar