REAKSI REDOKS
Assalamualaikum Warrahmatullahi Wabarakatuh
Halo sobat kimia😄
Pada pertemuan kali ini, kita akan membahas tentang REAKSI REDOKS. nantinya kita akan mempelajari bagaimana perkembangan konsep reduksi dan oksidasi (redoks) serta bagaimana penentuan bilangan oksidasi (biloks). Ayo kita belajar bersama ^^
Sobat kimia, coba kalian perhatikan fenomena gambar di atas. Pada gambar tersebut, dapat kita lihat sebuah apel yang telah terjadi perubahan warna setelah kita belah dan salah satunya kita diamkan beberapa saat di udara terbuka. Dalam proses kimia, reaksi yang menyebabkan perubahan warna tersebut terjadi karena adanya sebuah reaksi yang menyertainya yaitu reaksi redoks.
A. Perkembangan Konsep Reaksi Redoks
Reaksi oksidasi dan reaksi reduksi merupakan reaksi yang berjalan serentak, reaksi oksidasi tidak dapat berlangsung tanpa adanya reaksi reduksi begitu pula sebaliknya sehingga kedua reaksi ini seringkali disebut sebagai reaksi redoks (reduksi-oksidasi).
Ada tiga konsep penting yang harus kita ketahui terkait reaksi redoks.
1. Reaksi redoks ditinjau dari pelepasan dan pengikatan oksigen
a.) Oksidasi : reaksi penggabungan atau pengikatan oksigen oleh suatu zat.
Contoh :
C(S) + O2(g) → CO2(g)
b.) Reduksi: reaksi pelepasan oksigen oleh suatu zat.
Contoh :
HgO(S) → Hg(l) + ½O2(g)
Contoh lainnya terdapat pada reaksi pembakaran gas metana (CH4) dengan persamaan reaksi :
CH4(g) + 2O2(g) → CO2(g) + 2H2O(g)
Dalam Reaksi di atas terjadi penangkapan oksigen oleh C membentuk CO2, oleh karena itu reaksi ini dinamakan oksidasi. Sementara itu O2 sebagai sumber oksigen melepaskan oksigen pada reaksi ini, maka oksigen disebut sebagai oksidator yang mengalami reduksi.
Dalam reaksi oksidasi terdapat istilah oksidator dan reduktor. Oksidator merupakan senyawa yang mengalami reduksi dengan cara mengoksidasi senyawa lain dalam reaksi redoks. Sedangkan reduktor merupakan senyawa yang mengalami oksidasi dengan cara mereduksi senyawa lain dalam reaksi redoks
2. Reaksi redoks ditinjau dari serah terima elektron
a.) Oksidasi : reaksi pelepasan elektron
Contoh :
Ca → Ca2+ + 2e
b.) Reduksi: reaksi penangkapan atau penerimaan elektron.
Contoh :
S + 2e → S2-
Pada reaksi di atas Ca (kalsium) melepaskan dua buah elektron membentuk ion Ca2+, sedangkan S (belerang) menangkap dua buah elektron membentuk S2- pada waktu yang bersamaan. Dalam reaksi ini kalsium mengalami oksidasi dengan cara melepaskan elektron, sementara belerang mengalami reduksi dengan cara menangkap elektron yang dilepaskan oleh kalsium
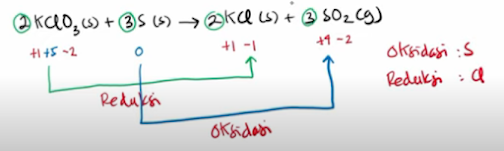
3. Reaksi redoks ditinjau dari perubahan bilangan oksidasi
a.) Oksidasi : reaksi yang mengalami peningkatan bilangan oksidasi.
b.) Reduksi: reaksi yang mengalami penurunan bilangan oksidasi.
Contoh :
B. Bilangan Oksidasi
1. Pengertian Bilangan Oksidasi
Bilangan oksidasi merupakan angka bermuatan pada suatu unsur yang menunjukkan jumlah elektron yang berperan dalam senyawa. Bilangan oksidasi suatu unsur ditentukan dengan memperhatikan ikatan dan struktur zat. Misalnya pada senyawa NaCl yang terbentuk melalui ikatan ion yakni dari ion Na+ dan Cl-, maka bilangan oksidasi Na adalah +1 dan bilangan oksidasi Cl adalah -1. Untuk contoh lainnya yakni senyawa HCl yang terbentuk melalui ikatan kovalen, H lebih elektropositif mempunyai bilangan oksidasi +1, sedangkan Cl lebih elektronegatif mempunyai bilangan oksidasi -1. Secara umum, untuk dua atom yang berikatan secara ionic maupun kovalen berlaku :
- Atom unsur dengan keelektronegatifan lebih besar akan mempunyai bilangan oksidasi negatif.
- Atom unsur dengan keelektronegatifan lebih kecil (lebih elektropositif) mempunyai bilangan oksidasi positif.
2. Penentuan Bilangan Oksidasi
Dengan memperhatikan ikatan, skala keelektronegatifan, dan struktur molekul, maka bilangan oksidasi suatu atom dapat ditentukan dengan ketentuan berikut :
- Bilangan oksidasi atom dalam unsur bebas (tidak bersenyawa) sama dengan 0 (nol), misalnya biloks atom pada unsur Na, Fe, Cu, H2, Cl2, Br2, I2, O pada O2, S pada S8, dan P pada P4 = 0.
- Jumlah aljabar bilangan oksidasi seluruh atom-atom dalam suatu senyawa netral adalah 0 (nol). Misalnya pada senyawa H2SO4, jumlah bilangan oksidasi dari penjumlahan 2 atom H + 1 atom S + 4 atom O = 0.
- Jumlah aljabar bilangan oksidasi seluruh atom-atom dalam suatu ion adalah sama dengan muatan ion tersebut. Misalnya pada ion Cr2O72-, jumlah bilangan oksidasi dari penjumlahan 2 atom Cr + 7 atom O = -2.
- Bilangan oksidasi logam golongan IA (Li, Na, K, Rb, Cs, Fr) dalam senyawa +1. Bilangan oksidasi logam golongan IIA (Be, Mg, Ca, Sr, Ba, Ra) dalam senyawa +2. Misalnya biloks Na dalam NaOH = +1, biloks K dalam KCl = +1, biloks Mg dalam MgO = +2, dan biloks Ca dalam CaCl2 = +2
- Bilangan oksidasi H (hidrogen) jika berikatan dengan unsur non logam adalah +1 (contohnya HF, H2O, HCl, dan lain-lain). Kecuali pada senyawa hidrida, yaitu hidrogen berikatan dengan logam alkali dan alkali tanah maka bilangan oksidasinya -1 (contohnya NaH, CaH2, dan lain-lain).
- Bilangan oksidasi O (oksigen) dalam senyawa umumnya -2 (senyawa oksida). Kecuali bilangan oksidasi O dalam senyawa peroksida adalah -1 (contohnya H2O2 dan Na2O2), bilangan oksidasi O dalam senyawa superperoksida adalah -½ (contohnya KO2 dan CsO2), bilangan oksidasi O dalam senyawa biner flourida adalah +2 (contohnya OF2)
- Bilangan oksidasi golongan VIIA atau halogen (F, Cl, Br, I) adalah -1. Misalnya bilok Cl dalam NaCl adalah -1.
- Bilangan oksidasi logam transisi dalam senyawanya bisa lebih dari satu, misalnya logam tembaga (Cu) ada yang memiliki biloks +1 dalam senyawa Cu2O, da nada yang memiliki biloks +2 dalam senyawa CuO


Komentar
Posting Komentar